
Encadrement des nanos dans les cosmétiques

Encadrement des nanos dans les cosmétiques
Par l’équipe AVICENN – Dernière modification novembre 2025
Nanomatériaux dans les cosmétiques : définition et obligation d’étiquetage
Une définition sans seuil minimal…
La définition du terme « nanomatériau » retenue par le Règlement Cosmétiques (2009) est la suivante :
« un matériau insoluble ou bio-persistant, fabriqué intentionnellement et se caractérisant par une ou plusieurs dimensions externes, ou une structure interne, sur une échelle de 1 à 100 nm ».
Elle est différente de la recommandation de définition de la Commission européenne de 2011 et, contrairement à cette dernière, ne comporte pas de seuil minimal de 50%.
Une tolérance de 10% est néanmoins appliquée par les autorités françaises de contrôle, afin de couvrir les incertitudes de mesure et une éventuelle contamination environnementale1Cf. Note d’information pour l’application de la définition des nanomatériaux dans le cadre du règlement (CE) n°1223/2009 relatif aux produits cosmétiques, DGCCRF & ANSM, 5 juillet 2021.
… qui pourrait évoluer prochainement
En 2022, la Commission a manifesté la volonté que sa nouvelle recommandation de définition du terme « nanomatériau » soit transposée dans le futur Règlement Cosmétiques révisé – sans que l’on ait plus d’information à ce stade sur les éventuelles adaptations qui pourraient être apportées à cette transposition.
NB : En 2012, le Bureau européen des unions de consommateurs (BEUC) avait proposé différentes modifications à la définition des nanomatériaux visant à mieux protéger les consommateurs des dangers potentiels posés par les nanomatériaux dans les cosmétiques2Voir le rapport « Nano-materials in cosmetic products: definition needs to effectively protect consumers », BEUC, Août 2012.
L’étiquetage [nano] des cosmétiques obligatoire depuis 2013…
En 2009, le Règlement Cosmétiques a rendu obligatoire, à compter de juillet 2013, le signalement de la présence des « nanomatériaux » (tels que définis plus haut) dans la liste des ingrédients des cosmétiques (article 19).
La règle d’étiquetage prévoit que soit indiqué le terme nano entre crochets après le nom de l’ingrédient concerné. Par exemple dans le cas du TiO2 : Titanium dioxyde [nano].
A noter : l’obligation d’étiquetage [nano] s’applique aux agrégats ou agglomérats3Pascal Courtellemont (LVMH Recherche) affirmait en octobre 2009 que le nano dioxyde de titane s’agglomère « lorsqu’il est mis dans les matrices cosmétiques. (…) On passe de tailles qui avoisinent les dizaines de nanomètres à 150 nanomètres, puis à des agglomérats à 1 ou 3 microns » ; source : Verbatim de la réunion d’Orléans, CNDP nano, 27 octobre 2009, s’ils sont composés de particules primaires ayant au moins une dimension inférieure à 100 nm, ainsi qu’aux particules peu ou pas « solubles » : les silices ne font pas exception4Cf. Opinion on solubility of Synthetic Amorphous Silica (SAS), Scientific Committee on Consumer Safety (SCCS), 20-21 juin 2019 (corrigendum du 6 décembre 2019).
… est insuffisamment appliqué par la filière cosmétique
Si l’on a pu avoir apparaître la mention [nano] sur certains cosmétiques dès 2014, des tests menés par des associations et les autorités publiques françaises (DGCCRF) ont mis en évidence que de nombreuses marques ont beaucoup tardé à se mettre en conformité avec l’obligation d’étiquetage5Le « Collectif des solaires bio », par exemple, s’y est plié en 2022 seulement. Voir par exemple le communiqué des Laboratoires Biarritz, janvier 2022… et que d’autres ne s’y sont toujours pas mises !
Ces tests mettent en effet chaque année en évidence la présence de nanoparticules (pas toujours autorisées) dans des cosmétiques, sans mention [nano] sur l’emballage.
- Certains industriels invoquent le fait que tout processus de broyage a pour effet de produire des particules de petite taille, dont une partie de taille nanoparticulaire qui ne devraient donc pas être considérées comme « intentionnellement » nano et échapperaient ainsi à l’obligation étiquetage. Cette interprétation, qui les arrange, n’est conforme ni aux textes réglementaires, ni à l’esprit de la loi, qui a été écrite afin de permettre une meilleure information et protection du consommateur. Les autorités françaises ont néanmoins considéré qu’un seuil de 10% permettait de fournir une certaine souplesse (cf. supra).
- Certaines marques n’ont pas jugé bon de se mettre en conformité avec la loi, au motif que cette dernière allait être amenée à changer – ce qui n’est pas recevable ni d’un point de vue réglementaire… ni d’un point de vue éthique. En 2022, la révision du règlement cosmétiques commence à peine et pourrait être l’occasion de revoir cette définition, articulée – ou pas – à la recommandation de définition du terme « nanomatériau » (en cours de révision). Mais la durée et l’issue de ces processus sont très incertains.
- Beaucoup rejettent la responsabilité sur leurs fournisseurs6Voir notamment :
–« Si certains (fournisseurs) n’ont pas la capacité ou la volonté de caractériser leurs ingrédients, l’information sera tronquée. Marie-Laure Gratadour Valcarcel, responsable de l’homologation des matières premières de la société Pierre Fabre, fabricant de cosmétiques, de compléments alimentaires et de médicaments, en a témoigné. Si des fournisseurs aux reins solides (…) sont en mesure de transmettre des éléments d’information sur leurs matières, des fournisseurs de matières (…) ont beaucoup plus de mal à produire des données ou à les transmettre ». Source : Compte rendu du forum NanoRESP du 19 juin 2018
– « Dans le baume lèvres Avène « les additifs/ingrédients sont intégralement sous forme nanométrique sans que le consommateur n’ait l’information de leur présence » , s’indigne l’association UFC Que Choisir. « Notre stick à lèvres Cold cream ne contient pas de nanomatériau au sens de la réglementation européenne sur les cosmétiques, ainsi qu’en attestent les certificats qui nous ont été délivrés par nos fournisseurs de matières premières », précise Avène. » Source : Nanoparticules : mise au point des laboratoires Avène, Le Moniteur des pharmacies, 24 janvier 2018, qui ne leur ont pas transmis l’information sur le caractère nanométrique de leurs ingrédients, ou pire, leur ont transmis des certificats assurant, à tort, qu’ils n’étaient PAS nanométriques ; mais les marques doivent assurer la maîtrise de l’approvisionnement en ingrédients et matières premières et contrôler davantage leurs produits finis, avec des contrôles basés sur des méthodes et outils adéquats, doublés d’une expertise solide. - D’autres arguments avancés témoignent d’une désinvolture (ou d’une mauvaise foi) peu en phase avec le sérieux et la responsabilité que les consommateurs sont en droit d’attendre des marques, à l’heure où l’on vante la « responsabilité sociale des entreprises » (RSE) : « il y a moins de 50 % de nanoparticules dans ma substance, je n’ai pas à l’étiqueter » : faux, la définition du Règlement cosmétiques ne comporte pas de seuil ; « mais alors, il faudrait quasiment tout étiqueter nano, donc ça n’a pas de sens ! » : faux encore…
Au final, les marques qui ont joué la montre et la carte de l’attentisme depuis 2013, en ne respectant pas l’obligation d’étiquetage [nano] ont ainsi illégalement « gagné » au moins une dizaine d’années à ne pas étiqueter, pendant lesquelles la Commission européenne a fermé les yeux !
Force est de reconnaître que certains problèmes de non-conformité, fort regrettables, ont trait au fait que la réglementation est quelque peu confuse. Aux problèmes de définition mentionnés plus haut s’ajoute la complexité du processus d’autorisation qui peut conduire à la situation, relativement ubuesque où une substance peut ne pas (encore) être « interdite »… sans pour autant être expressément « autorisée » (cf. plus bas). Reste que même lorsqu’elles ne sont pas formellement « interdites », ces substances doivent être étiquetées [nano] !
Et si tous les fournisseurs ne précisent pas nécessairement la dimension nanométrique des ingrédients qu’ils vendent aux marques7« Le problème de la présence ou de l’absence de nanoparticules dans un produit peut se révéler plus complexe encore dès que la chaîne de fabrication d’un produit intègre des ingrédients provenant de différents fournisseurs. Si certains d’entre eux n’ont pas la capacité ou la volonté de caractériser leurs ingrédients, l’information sera tronquée. Marie-Laure Gratadour Valcarcel, responsable de l’homologation des matières premières de la société Pierre Fabre, fabricant de cosmétiques, de compléments alimentaires et de médicaments, en a témoigné. Si des fournisseurs aux reins solides (…) sont en mesure de transmettre des éléments d’information sur leurs matières, des fournisseurs de matières (…) ont beaucoup plus de mal à produire des données ou à les transmettre ». Source : Compte rendu du forum NanoRESP du 19 juin 2018 ou présentent des certificats « sans nano » erronés (car basés sur des mesures inadaptées réalisées avec des méthodes d’analyses inaptes à mesurer des particules de taille inférieure à 100 nm par exemple !), les marques sont responsables des produits qu’elles mettent sur le marché et doivent vérifier les informations de leurs fournisseurs : si les analyses documentaires des « fiches produits » sont nécessaires, des contrôles supplémentaires en laboratoires sont une garantie plus fiable – à la condition qu’ils soient menés avec des méthodes et outils adéquats, doublés d’une expertise solide.
La DGCCRF de son côté poursuit donc ses contrôles et a déjà obtenu des retraits ou mise en conformité de produits (cf. ci-dessous).
Et heureusement, certaines marques ou fédérations ont pris au sérieux la question nano. Cosmed par exemple, association des PME de la filière cosmétique, a ainsi produit des documents à destination de ses adhérents (et mis à disposition du public également) en déployant un vrai effort de pédagogie, remarquable par la qualité et la rigueur de ses informations8Cf. Nano or not Nano ? (vidéo), Cosmed, mai 2022 et NANOMATERIAUX : Cosmed démêle le vrai du faux, (communiqué), Cosmed, février 2021.
Mise sur le marché de nanos : autorisations & déclarations préalables
Pour les professionnels, il y a obligation de notification de tous les ingrédients nanos utilisés, notamment sur le « Cosmetic Products Notification Portal » (CPNP) de la Commission européenne.
Les 6 nanomatériaux autorisés en cosmétique (sous conditions)
- un colorant et un seul (annexe IV) : le noir de carbone (CI 77266)9L’avis sur le nano noir de carbone a été publié le 12 décembre 2013 (en réponse à la Request for a scientific opinion on the colorant Carbon Black, CI 77266 nano CAS n. 1333-86-4, EC n. 215-609-9) de la Commission européenne), révisé en mars 2014 et complété en septembre 2014 : Scientific Opinion for clarification of the meaning of the term « sprayable applications/products » for the nano forms of Carbon Black CI 77266, Titanium Oxide and Zinc Oxide, SCCS (publication juin 2015)
→ aucune autre substance n’est autorisée comme colorant sous forme nano10Cf. article 14 du règlement (CE) n°1226/2009 : ni le dioxyde de titane (TiO2), ni les oxydes de fer que l’on retrouve pourtant dans de nombreux produits de maquillage !
- cinq filtres UV sont aujourd’hui expressément autorisés (annexe VI), mais pas sous forme de spray afin d’éviter les risques potentiels entraînés par leur inhalation :
- nano oxyde de zinc (ZnO)11L’avis initial sur l’oxyde de zinc publié en 2012 a été complété avril 2014 et encore en septembre 2014 (avec une publication en juin 2015). ⇒ En avril 2016, les nanoparticules d’oxyde de zinc ont ainsi été rajoutées à l’annexe VI du Règlement Cosmétiques, autorisant à partir de mai 2016 leur utilisation dans les cosmétiques à une concentration maximale de 25 % (sauf pour les applications susceptibles de donner lieu à une exposition des poumons des utilisateurs ; l’utilisation dans un spray est donc interdite pour éviter l’inhalation) (cf. Règlement (UE) 2016/621 modifiant l’annexe VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques, Commission européenne, 21 avril 2016). Cette autorisation a suscité l’émoi d’Olivier Toma, du Comité de développement durable en santé (C2DS) dans la mesure où ces particules sont toxiques pour les organismes aquatiques (cf. Filtres solaires à l’oxyde de zinc : danger écotoxicologique !, Olivier Toma, C2DS, 24 mai 2016)
- nano dioxyde de titane (TiO2)*12L’avis sur les nanoparticules de dioxyde de titane (TiO2) a été publié le 23 juillet 2013 et révisé plusieurs fois, les derniers documents que nous avions recensés étant ceux-ci :
– Scientific Opinion for clarification of the meaning of the term « sprayable applications/products » for the nano forms of Carbon Black CI 77266, Titanium Oxide and Zinc Oxide, SCCS, septembre 2014 (publication juin 2015)
– Opinion on Titanium Dioxide (nano form) coated with Cetyl Phosphate, Manganese Dioxide or Triethoxycaprylylsilane as UV-filter in dermally applied cosmetic , SCCS, mars 2017 : (given the) « general lack of dermal absorption and low general toxicity of nano-forms of titanium dioxide, the SCCS considers that the use of the three TiO2 nanomaterials coated with either cetyl phosphate, manganese dioxide or triethoxycaprylylsilane, can be considered safe for use in cosmetic products intended for application on healthy, intact or sunburnt skin. This, however, does not apply to applications that might lead to exposure of the consumer’s lungs to the TiO2 nanoparticles through the inhalation route (such as powders or sprayable products). »
– Opinion on Titanium Dioxide (nano form) as UV-Filter in sprays, SCCS, janvier 2018 : « the SCCS has concluded that the information provided is insufficient to allow assessment of the safety of the use of nano-TiO2 in spray applications that could lead to exposure of the consumer’s lungs. (…) there are already sprayable products on the market containing nano forms of TiO2. Such uses need to be carefully evaluated so that the chance of harmful effects through consumer’s lung exposure by inhalation is avoided » (Le produit concerné : PARSOL® TX de DSM)
→ La forme nano des particules de dioxyde de titane a été introduite dans l’annexe VI du Règlement Cosmétiques (celle qui concerne les filtres solaires) en juillet 2016 pour une entrée en vigueur dès août 2016, à une concentration maximale de 25 % (sauf pour les applications susceptibles de donner lieu à une exposition des poumons des utilisateurs ; l’utilisation dans un spray est interdite pour éviter l’inhalation du fait des risques associés aux nanoparticules de dioxyde de titane). Cf. Règlement 2016/1143 du 13 juillet 2016, publié au Journal officiel de l’Union Européenne le 14 juillet - nano TBPT (tris-biphenyl triazine, présent dans le Tinosorb® A2B de BASF)13Cf. Règlement (UE) n° 866/2014 de la Commission européenne modifiant les annexes III, V et VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques, 8 août 2014 ; voir également Un filtre UV micronisé autorisé pour les cosmétiques dans l’UE, Premium Beauty News, septembre 2014
- nano MBBT (methylene bis-benzotriazolyl tetramethylbutylphenol)14Un avis du SCCS sur le MBBT avait été publié en 2013 et révisé en 2015 : Opinion on 2,2′-Methylene-bis-(6-(2H-benzotriazol-2-yl)-4-(1,1,3,3-tetramethylbutyl)phenol) (nano form), Submission III, SCCS, Mars 2015 (publication juin 2015). Le 28 février 2018, un « draft » de Règlement a été validé lors d’une réunion du Standing Committee on Cosmetic Products. Le Règlement (UE) 2018/885 de la Commission modifiant l’annexe VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques a été finalisé le 20 juin 2018 et est entré en vigueur le mois suivant. Il autorise l’utilisation de MBBT sous la forme de nanoparticules comme filtre ultraviolet dans les produits cosmétiques, conformément aux spécifications du CSSC, à une concentration de 10 % m/m, sauf pour les applications susceptibles de donner lieu à une exposition des poumons de l’utilisateur final par inhalation de cette substance.
- nano HAA299 (Bis-(Diethylaminohydroxybenzoyl Benzoyl) Piperazine)15Cf. Règlement (UE) 2022/2195 de la Commission du 10 novembre 2022 modifiant le règlement (CE) no 1223/2009 du Parlement européen et du Conseil en ce qui concerne l’utilisation des substances «Butylated Hydroxytoluene», «Acid Yellow 3», «Homosalate» et «HAA299» dans les produits cosmétiques et rectifiant ledit règlement en ce qui concerne l’utilisation de «Resorcinol» dans les produits cosmétiques. Il peut être utilisé en tant que nanomatériau si la taille médiane des particules D50 (50 % du nombre en dessous de ce diamètre) est ≥ 50 nm sur la base de la distribution numérique par taille.
Comme les autres nanomatériaux autorisés en cosmétique, il ne pourra pas être utilisé dans des applications pouvant conduire à l’exposition des poumons de l’utilisateur final par inhalation pour éviter de potentiels risques sanitaires.
* L’utilisation quasi systématique du dioxyde de titane pour des applications où la fonction anti-UV n’est pas strictement nécessaire est controversée, notamment dans les crèmes antirides : « Dans une crème de soin à visée purement esthétique comme un antirides, la présence de filtres UV à risque avéré, ou même seulement soupçonnés de toxicité, n’est pas acceptable » » indiquait ainsi 60 Millions de consommateurs en 201816Cf. « Crèmes antirides : des filtres UV malvenus », 60 Millions de consommateurs, 25 octobre 2018.
Fin juin 2022, la Commission européenne a demandé au Comité scientifique pour la sécurité des consommateurs (SCCS) de réévaluer la sécurité du TiO2 dans les cosmétiques, eu égard à sa génotoxicité en cas d’exposition par inhalation et par voie orale. Parmi les types de cosmétiques mentionnés : les baumes à lèvres, rouges à lèvres, dentifrices, poudres, sprays pour cheveux. Dans son avis scientifique sur le dioxyde de titane (TiO2) 1661/23 rendu en mai 2024, le Comité européen pour la sécurité des consommateurs (SCCS) considère que les données fournies par l’industrie pour 44 TiO2 pigmentaires et 40 TiO2 nanos, ne sont pas suffisantes pour exclure le potentiel de génotoxicité de presque tous les types de TiO217(82 sur 84) utilisés dans les produits cosmétiques oraux et que davantage de données expérimentales sont donc nécessaires pour exclure le potentiel de génotoxicité des qualités de TiO2 (pigmentaires et nano) utilisées dans les produits cosmétiques oraux, à l’exception de deux TiO2 nano18(RM09 et RM11, pour lesquels les données de génotoxicité fournies n’indiquent aucun problème de génotoxicité).
Le CSSC ajoute également que, compte tenu du fait que les cellules de la muqueuse buccale sont susceptibles d’absorber des nanoparticules (y compris des nanoparticules de TiO2) et que certains produits buccaux tels que les dentifrices contenant des nanoparticules de TiO2, tels que les dentifrices, seront utilisés tous les jours et potentiellement plus d’une fois par jour, des recherches supplémentaires sont nécessaires pour exclure le risque pour le consommateur d’expositions répétées à long terme de la muqueuse buccale aux nanoparticules de TiO2..
Les 12 nanomatériaux interdits en cosmétique
En mars 2024, suite aux préoccupations sanitaires relevées par le Comité scientifique pour la sécurité des consommateurs (CSSC), la Commission européenne a publié un règlement 2024/858 interdisant l’utilisation, dans les cosmétiques, de cinq groupes de douze nanomatériaux au total :
- styrène acrylate copolymère, styrène de sodium acrylate copolymère,
- cuivre, cuivre colloïdal,
- argent colloïdal
- or, or colloïdal, acide thioéthylaminohyaluronique d’or, or colloïdal acétylheptapeptide-9,
- platine, platine colloïdal et platine colloïdal acétyltétrapeptide-17.
Les cosmétiques qui contiennent cette substance ne pourront plus :
- être mis sur le marché de l’Union européenne par les fabricants ou importateurs à partir du 1er février 2025
- être mis à disposition par les distributeurs, grossistes ou détaillants à partir du 1er novembre 2025.
Un nanomatériau restreint : l’hydroxyapatite (HAP)
Le même règlement 2024/858 restreint le nanomatériau hydroxyapatite (HAP) en l’ajoutant à l’annexe III du Règlement Cosmétiques qui liste les substances qui ne peuvent être utilisées en dehors des restrictions prévues. En l’occurrence, l’HAP nano ne pourra plus être utilisée dans les dentifrices qu’en concentration inférieure à 10% et dans les bains de bouche qu’en concentration inférieure à 0,465 %. Elle ne devra pas être utilisée dans des applications pouvant conduire à l’exposition des poumons de l’utilisateur final par inhalation. Seuls seront autorisées les HAP nano dont :
- les [composés de] particules en forme de bâtonnets ayant au moins 95,8 % (en nombre de particules) ont un rapport d’aspect inférieur à 3 et les 4,2 % restants ont un rapport d’aspect ne dépassant pas 4,9,
- les particules sont non recouvertes ni modifiées en surface.
Même délais ici : les cosmétiques qui contiennent cette substance et qui ne respectent pas ces restrictions ne pourront plus être mis sur le marché de l’UE à partir du 1er février 2025, ni être mis à disposition à partir du 1er novembre 2025.
Deux types d’autorisation
Le Règlement Cosmétiques prévoit deux types d’autorisations, selon que les nanomatériaux sont utilisés ou non comme colorants, filtres UV et conservateurs ou pas :
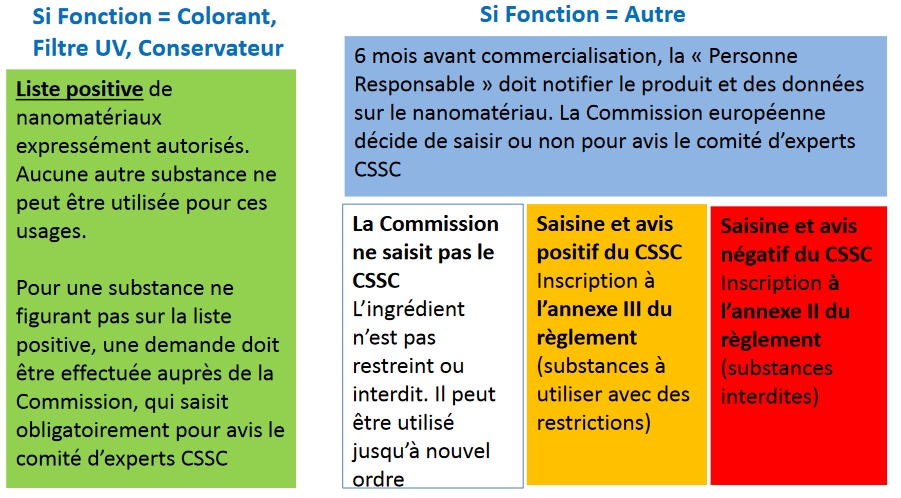
L’autorisation expresse
Une autorisation « expresse » a été mise en place pour les substances utilisées comme colorant, filtre UV ou conservateur et inscrites (a posteriori) dans les annexes du Règlement19Au 11 juillet 2013, date de l’entrée en vigueur de la réglementation, le CSSC n’avait pas rendu tous ses avis sur les principaux nano-ingrédients utilisés en cosmétique en réponse à l’industrie cosmétique qui souhaitait leur insertion dans les annexes du Règlement Cosmétiques pour pouvoir les utiliser sans déclaration préalable.
Mais il a ensuite rattrapé son retard. Cf. ci-dessous..
La notification avant mise sur le marché
Pour les substances ayant une autre fonction, une déclaration préalable (six mois avant leur mise sur le marché) doit être faite par le metteur sur le marché auprès de la Commission européenne20Cf. article 16 du règlement (CE) n°1226/2009. Cette dernière peut demander l’avis du Comité scientifique pour la sécurité des consommateurs (CSSC).
- nanosilice et ses dérivés : le CSSC a rendu un avis en mars 2015, stipulant que les données fournies par les entreprises et la littérature scientifiques étaient alors inadéquates et insuffisantes pour tirer une conclusion sur l’innocuité ou la dangerosité des nano-silices21En octobre 2013, la Commission européenne, inquiète suite aux 172 notifications de produits contenant des nano-silices, avait pris l’initiative de demander au CSSC un avis sur les nanosilices : Request for a scientific opinion on Silica (nano) CAS n.l 12945-52-5; Hydrated Silica(nano) CAS n. 112926-00-8; Silica Sylilate CAS n. 68909-20-6; Silica Dimethyl silylate (nano) CAS n. 68611-44-9, 2 octobre 2013. Le CSSC a lancé un appel à information entre février et mai 2014 : Call for Information on the safety of Silica (nano) : Silica (nano) CAS n. 112945-52-5; Hydrated Silica(nano) CAS n. 112926-00-8; Silica Sylilate (nano) CAS n. 68909-20-6; Silica Dimethyl Silylate (nano) CAS n. 68611-44-9, février 2014. Puis il a adopté un avis en mars 2015 : Opinion on Silica, Hydrated Silica, and Silica Surface Modified with Alkyl Silylates (nano form), SCCS, mars 2015. Selon le CSSC, les données fournies par les entreprises et la littérature scientifiques étaient alors inadéquates et insuffisantes pour tirer une conclusion sur l’innocuité ou la dangerosité des nano-silices.
A la suite de cette publication, le CSSC a reçu de nombreux commentaires de la part de parties prenantes. En septembre 2015, la Commission a fait savoir que le CSSC allait décider à l’automne s’il allait ou non, en fonction de ces commentaires, produire un avis révisé sur les nano-silices et que la Commission réfléchirait ensuite aux mesures appropriées à déployer afin d’assurer une utilisation sûre des nano-silices dans les produits cosmétiques (cf. Réponse de la commissaire Elzbieta Bienkowska au courrier de juillet 2015 de deux députés européens du groupe Les Verts/Alliance libre européenne, Michèle Rivasi et Bas Eickhout, 3 septembre 2015.
En 2021, le même comité a conclu de nouveau qu’ « il y a lieu de craindre que l’utilisation de matériaux SAS présente un risque pour la santé du consommateur »22Cf. Scientific advice on the safety of nanomaterials in cosmetics, SCCS, 2021 (annex IV). In October 2025, following the belated submission of safety data by industry, the European Commission requested a definite safety assessment from SCCS on synthetic amorphous silica used in cosmetics (« hydrated silica », « pyrogenic silica », « silica silylate » et « silica dimethyl silylate »), specifically in their nano forms[/mfn]Cf. Request for a scientific Opinion on the safety of Hydrated Silica (nano), Pyrogenic Silica (nano), Silica Silylate (nano), and Silica Dimethyl Silylate (nano) , European Commission, 30 October 2025[/mfn]. → The new opinion of SCCS is expected by November 2026 (more than ten years after the 2015 opinion, which highlighted the lack of data…).. - nano-or : l’avis du CSSC daté de mars 2021 stipule qu’il est impossible d’effectuer une évaluation de la sécurité des nanomatériaux d’or, or colloïdal et or modifié en surface en raison de l’insuffisance ou de l’absence d’informations essentielles ; il s’inquiète également d’un risque pour la santé humaine possible, en raison notamment de l’absorption systémique des nanoparticules d’or (ce qui peut conduire à une accumulation dans certains organes – notamment le foie et la rate) et de leurs effets mutagènes/génotoxiques potentiels23Cf. Opinion on Gold (nano), Colloidal Gold (nano), Gold Thioethylamino Hyaluronic Acid (nano) and Acetyl heptapeptide-9 Colloidal gold (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), juin 2021 ; cet avis, attendu initialement pour avril 2020, a été rédigé suite à la demande de la Commission européenne formulée fin 2019 ; le SCCS y souligne que la littérature scientifique suggère une possible absorption systémique des nanoparticules d’or (ce qui peut conduire à une accumulation dans certains organes – notamment le foie et la rate) et des effets mutagènes/génotoxiques potentiels des nanomatériaux d’or. Le SCCS conclut qu’il y a lieu de s’inquiéter du fait que l’utilisation de matériaux en or (nano), en or colloïdal (nano) et en or modifié en surface (nano) dans les produits cosmétiques puisse présenter un risque pour la santé humaine > l’interdiction est attendue pour 2022
- nano-hydroxyapatite sous formes d’aiguilles : en 2016 et de nouveau en 2021, le CSSC avait considéré qu’il ne devait pas être utilisé dans les cosmétiques, en raison de sa toxicité potentielle24Voir :
– Opinion on Hydroxyapatite (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), mars 2021
– Opinion on Hydroxyapatite (nano), Scientific Committee on Consumer Safety (SCCS), mars 2016 avant de revenir sur sa position, dans un nouvel avis de 2023 considérant comme sûre son utilisation, sous conditions, à une concentration maximale de 10% dans les dentifrices et de 0,465% dans les bains de bouche25Cf. Opinion on HAP (hydroxyapatite) nano, Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), mars 2023 - nanoargent (dont argent colloidal) : selon l’avis du CSSC, publié en octobre 2018 les données recueillies ne permettent pas de s’assurer de l’innocuité du nanoargent dans les applications cosmétiques26Voir notamment :
– Opinion Colloidal Silver (nano), SCCS, octobre 2018
– Call for data on ingredients of Colloidial silver nano in the framework of Regulation 1223/2009 on Cosmetic products, SCCS, mars 2015
– Request for a scientific opinion: Colloidal Silver (nano) CAS No 7440-22-4, EC No 231-131-3, SCCS, date ?
– Minutes of the 5th Plenary Meeting of the Scientific Committee on Consumer Safety (SCCS), 24-25 octobre 2017 : « A request for information and clarification was sent back to Applicants with a deadline by 30 September 2017. Four replies from 3 Applicants have been received and are under assessment. » - styrene/acrylates copolymer (nano) et sodium styrene/acrylates copolymer (nano) : même conclusion que dans le cas de l’argent colloïdal / nanoargent27Cf. Preliminary Opinion on Styrene/Acrylates copolymer (nano) and Sodium styrene/Acrylates copolymer (nano), Sccs, février 2018 (soumise à consultation jusqu’au 11 mai 2018) : « The SCCS cannot conclude on the safety of any of the three styrene/acrylate copolymer nano-entities submitted by the Applicants. The data submitted are insufficient to evaluate possible toxicity. Regarding use it was reported that the nano-entities as present in Nanospheres 100 Theophyllisilane C (SA), were used for encapsulation of a slimming agent Theophyllisilane C. According to the information provided by the Applicants, the formulation might be used in health products like milks, emulsions, creams, lotions and solutions » > l’interdiction est attendue pour 2022
- nano-cuivre : l’avis du SCCS publié en mars 2021 fait état d’un manque de données suffisantes (en termes de caractérisation et de toxicologie) pour lui permettre d’évaluer le cuivre sous forme nano ; l’avis pointe néanmoins le risque d’accumulation dans certains organes – notamment le foie et la rate – liés à une exposition systémique, ainsi que des effets mutagènes / génotoxiques et immunotoxiques / néphrotoxiques potentiels qui justifient une évaluation plus approfondie de la sécurité des nanomatériaux de cuivre utilisés comme ingrédients cosmétiques28Cf. [[https://ec.europa.eu/health/sites/default/files/scientific_committees/consumer_safety/docs/sccs_o_245.pdf Opinion on Copper (nano) and Colloidal Copper (nano)]], Sccs, 5 mars 2021 > l’interdiction est attendue pour 2022.
- nano-platine : l’avis du SCCS publié en juin 2021 fait là aussi état d’un manque de données suffisantes et d’inquiétude quant au risque pour le consommateur29Preliminary Opinion on Platinum (nano), Colloidal Platinum (nano) and Acetyl tetrapeptide-17 Colloidal Platinum (nano), Sccs, 24-25 juin 2021 > l’interdiction est attendue pour 2022
- fullérènes : en 2023, le SCCS a considéré que les fullérènes hydroxylés ne peuvent pas être utilisés en toute sécurité dans les cosmétiques30Cf. Opinion on Fullerenes, Hydroxylated Fullerenes and hydrated forms of Hydroxylated Fullerenes (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), novembre 2023
NB : Fin octobre 2019, le Comité Scientifique Européen pour la Sécurité des Consommateurs (SCCS) a adopté un document, révisé en 2023 « Guidance on the Safety Assessment of Nanomaterials in Cosmetics« , qui intègre les récents développements dans le domaine de la recherche sur la sécurité des nanomatériaux afin d’aider les fabricants et évaluateurs dans leur travail de caractérisation et évaluation des risques sanitaires liés aux nanomatériaux utilisés dans le domaine cosmétique.
(Sans oublier la déclaration française dans r-nano)
En France, les « substances à l’état nanoparticulaires » utilisées dans les cosmétiques sont soumises, comme les autres nanomatériaux, à l’obligation de déclaration au registre R-nano.
La déclaration dans R-nano n’exonère par les fabricants de l’obligation de notification européenne sur le CPNP, et vice-versa.
Dans le registre r-nano, la catégorie de produits « cosmétiques, produits de soins personnels » (PC 39) était la deuxième catégorie la plus déclarée avec 616 déclarations en 2017. Mais, en l’état actuel du registre, les produits qui contiennent ces substances nano ne peuvent pas être identifiés, d’où la nécessité d’apporter des améliorations à la procédure de déclaration française.
Certains fabricants de cosmétiques se plaignent de la « contrainte administrative » liée au fait que les déclarations dans R-nano et dans le CPNP ne sont pas basées sur les mêmes définitions du terme « nanomatériau » et que leurs fournisseurs ne leur transmettent pas correctement et/ou très tardivement les données nécessaires.
Néanmoins les marques ont la responsabilité de s’assurer de la qualité de leurs matières premières et ont toujours la possibilité de les faire tester, en recourant aux méthodes et outils adéquats.
Quels contrôles par les autorités ?
En France
La DGCCRF31Voir notamment :
– Contrôle de la présence de nanoparticules dans les produits alimentaires et les cosmétiques par la DGCCRF, DGCCRF, janvier 2018
– Nanomatériaux dans les produits cosmétiques : la DGCCRF fait le point, DGCCRF, 22 février 2021
– Composition des cosmétiques : l’exigence d’une information claire des consommateurs, DGCCRF, 15 octobre 2019 et l’ANSM32– Cf. Bilan des inspections des produits cosmétiques à l’ANSM, ANSM, Congrès Parfums & Cosmétiques, 4 novembre 2020 : l’ANSM a présenté les résultats de tests qu’elle a fait mener en 2019 sur 12 dentifrices de marques différentes, complétant les analyses menées par la DGCCRF sur 5 autres dentifrices. Malheureusement, ces résultats n’ont pas été rendus publics en dehors des congrès réservés aux marques cosmétiques et l’ANSM n’a jamais répondu aux demandes de précisions d’AVICENN. vérifient l’application par les entreprises des dispositions du Règlement Cosmétiques concernant les nanos sur le territoire français.
Depuis 2017, la DGCCRF a mené des contrôles qui sont venus confirmer les défaillances de l’étiquetage [nano] ainsi que la présence de nanomatériaux non autorisés (oxyde de fer et dioxyde de titane nano utilisés comme colorants par exemple). Depuis 2020, la DGCCRF a réalisé des injonctions de remise en conformité des étiquetages et a obtenu le retrait volontaire d’une dizaine de produits par les entreprises (principalement du maquillage).
La « feuille de route » issue de la conférence environnementale 2016 avait prévu d’accélérer l’encadrement de l’usage des nanomatériaux dans les filtres UV des produits cosmétiques dans le cadre de l’application du règlement européen, et notamment l’entrée en vigueur au niveau national des mesures concernant l’emploi du dioxyde de titane sous forme nano« . Le ministère de la santé et la DGCCRF sont les acteurs clés de cette « action ».
Après de premiers tests sur des cosmétiques autres que des produits solaires en 2016-2017, la DGCCRF s’est penchée, à partir de 2018, plus spécifiquement les nanoparticules de dioxyde de titane (TiO2) et d’oxyde de zinc (ZnO) dans les produits de protection solaire, afin de vérifier le respect de l’obligation européenne d’étiquetage des nanomatériaux dans les cosmétiques, en vigueur depuis 2013.
Elle a mis en évidence de nombreuses non conformités : l’absence de mention [nano] dans des produits contenant du dioxyde de titane ou de l’oxyde de zinc sous forme nanoparticulaire.
Ailleurs en Europe ?
Il semble que la France soit le seul pays de l’Union européenne où sont effectués ces contrôles par les autorités publiques. A quand des contrôles similaires dans les autres Etats membres ?
La DGCCRF a communiqué sur sa démarche et ses résultats à la Commission européenne depuis février 2018. Les autres pays pourraient bénéficier de ce retour d’expériences pour effectuer eux aussi des contrôles sur leur territoire.
L’avance de la France en la matière s’explique probablement par les tests menés par les associations qui a conduit aux tests et au travail de sensibilisation des entreprises par la DGCCRF depuis plusieurs années ainsi que par la déclaration obligatoire via le registre r-nano que les entreprises françaises (et celles de l’étranger vendant leurs produits en France) ont intégré à leurs pratiques : la France est le pays qui arrive très largement en tête du nombre de notifications de nanomatériaux dans le Portail de notification des produits cosmétiques (CPNP), avec près de 16 500 notifications (soit ~44 % des notifications européennes !), près de quatre fois plus que l’Italie et Allemagne qui arrivent en 2e et 3e positions, selon un rapport de la Commission européenne publié en 202133Cf. Rapport sur l’utilisation de nanomatériaux dans les produits cosmétiques et la révision du règlement (CE) nº 1223/2009 relatif aux produits cosmétiques en ce qui concerne les nanomatériaux, Commission européenne, juillet 2021.
Voilà un élément supplémentaire qui plaide en faveur d’un registre européen des nanomatériaux.
Aux États-Unis
Voir le chapitre « Sunscreens Containing Nanomaterials » dans le document en anglais : Sunscreen Drug Products for Over-the-Counter Human Use – A Proposed Rule by the Food and Drug Administration, FDA, février 2019
Une question, une remarque ? Cette fiche réalisée par AVICENN a vocation à être complétée et mise à jour. N'hésitez pas à apporter votre contribution.
Les actus sur le sujet
D’autres fiches pour approfondir
Les prochains RDV nanos
- 19ème réunion du comité de dialogue « nano et santé »
- Organisateur : ANSES
- Conférence internationale MATÉRIAUX 2026
- Colloque #11 : Nanomatériaux, matériaux poreux et à grande surface spécifique
- Organisateur : Fédération Française des Matériaux (FFM)
- Website : https://materiaux2026.org

- Programme de e-learning : sensibilisation destinée aux personnels au contact de nanomatériaux en phase de recherche, formulation, production, maintenance, nettoyage, entretien… ainsi qu’aux animateurs ou ingénieurs de sécurité, chefs d’installation, chefs de laboratoires où sont manipulées des nanoparticules.
- Organisateur : INSTN Grenoble (CEA)
- Au programme :
- 1 – Introduction, définition et caractéristiques des nanomatériaux
- 2 – Toxicité des nanomatériaux : l’état des connaissances
- 3 – Métrologie et caractérisation des nanomatériaux
- 4 – Moyens de prévention et de protection des nanomatériaux au poste de travail
- 5 – Quiz : évaluation des acquis d’apprentissage
- La formation de 2h est consultable pendant un mois à partir de la date d’inscription.
- Site internet : https://instn.cea.fr/…risques-lies-aux-nanomateriaux…
Cette fiche a été initialement créée en février 2019
Notes and references
- 1
- 2Voir le rapport « Nano-materials in cosmetic products: definition needs to effectively protect consumers », BEUC, Août 2012
- 3Pascal Courtellemont (LVMH Recherche) affirmait en octobre 2009 que le nano dioxyde de titane s’agglomère « lorsqu’il est mis dans les matrices cosmétiques. (…) On passe de tailles qui avoisinent les dizaines de nanomètres à 150 nanomètres, puis à des agglomérats à 1 ou 3 microns » ; source : Verbatim de la réunion d’Orléans, CNDP nano, 27 octobre 2009
- 4Cf. Opinion on solubility of Synthetic Amorphous Silica (SAS), Scientific Committee on Consumer Safety (SCCS), 20-21 juin 2019 (corrigendum du 6 décembre 2019)
- 5Le « Collectif des solaires bio », par exemple, s’y est plié en 2022 seulement. Voir par exemple le communiqué des Laboratoires Biarritz, janvier 2022
- 6Voir notamment :
–« Si certains (fournisseurs) n’ont pas la capacité ou la volonté de caractériser leurs ingrédients, l’information sera tronquée. Marie-Laure Gratadour Valcarcel, responsable de l’homologation des matières premières de la société Pierre Fabre, fabricant de cosmétiques, de compléments alimentaires et de médicaments, en a témoigné. Si des fournisseurs aux reins solides (…) sont en mesure de transmettre des éléments d’information sur leurs matières, des fournisseurs de matières (…) ont beaucoup plus de mal à produire des données ou à les transmettre ». Source : Compte rendu du forum NanoRESP du 19 juin 2018
– « Dans le baume lèvres Avène « les additifs/ingrédients sont intégralement sous forme nanométrique sans que le consommateur n’ait l’information de leur présence » , s’indigne l’association UFC Que Choisir. « Notre stick à lèvres Cold cream ne contient pas de nanomatériau au sens de la réglementation européenne sur les cosmétiques, ainsi qu’en attestent les certificats qui nous ont été délivrés par nos fournisseurs de matières premières », précise Avène. » Source : Nanoparticules : mise au point des laboratoires Avène, Le Moniteur des pharmacies, 24 janvier 2018 - 7« Le problème de la présence ou de l’absence de nanoparticules dans un produit peut se révéler plus complexe encore dès que la chaîne de fabrication d’un produit intègre des ingrédients provenant de différents fournisseurs. Si certains d’entre eux n’ont pas la capacité ou la volonté de caractériser leurs ingrédients, l’information sera tronquée. Marie-Laure Gratadour Valcarcel, responsable de l’homologation des matières premières de la société Pierre Fabre, fabricant de cosmétiques, de compléments alimentaires et de médicaments, en a témoigné. Si des fournisseurs aux reins solides (…) sont en mesure de transmettre des éléments d’information sur leurs matières, des fournisseurs de matières (…) ont beaucoup plus de mal à produire des données ou à les transmettre ». Source : Compte rendu du forum NanoRESP du 19 juin 2018
- 8Cf. Nano or not Nano ? (vidéo), Cosmed, mai 2022 et NANOMATERIAUX : Cosmed démêle le vrai du faux, (communiqué), Cosmed, février 2021
- 9L’avis sur le nano noir de carbone a été publié le 12 décembre 2013 (en réponse à la Request for a scientific opinion on the colorant Carbon Black, CI 77266 nano CAS n. 1333-86-4, EC n. 215-609-9) de la Commission européenne), révisé en mars 2014 et complété en septembre 2014 : Scientific Opinion for clarification of the meaning of the term « sprayable applications/products » for the nano forms of Carbon Black CI 77266, Titanium Oxide and Zinc Oxide, SCCS (publication juin 2015)
- 10Cf. article 14 du règlement (CE) n°1226/2009
- 11L’avis initial sur l’oxyde de zinc publié en 2012 a été complété avril 2014 et encore en septembre 2014 (avec une publication en juin 2015). ⇒ En avril 2016, les nanoparticules d’oxyde de zinc ont ainsi été rajoutées à l’annexe VI du Règlement Cosmétiques, autorisant à partir de mai 2016 leur utilisation dans les cosmétiques à une concentration maximale de 25 % (sauf pour les applications susceptibles de donner lieu à une exposition des poumons des utilisateurs ; l’utilisation dans un spray est donc interdite pour éviter l’inhalation) (cf. Règlement (UE) 2016/621 modifiant l’annexe VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques, Commission européenne, 21 avril 2016). Cette autorisation a suscité l’émoi d’Olivier Toma, du Comité de développement durable en santé (C2DS) dans la mesure où ces particules sont toxiques pour les organismes aquatiques (cf. Filtres solaires à l’oxyde de zinc : danger écotoxicologique !, Olivier Toma, C2DS, 24 mai 2016)
- 12L’avis sur les nanoparticules de dioxyde de titane (TiO2) a été publié le 23 juillet 2013 et révisé plusieurs fois, les derniers documents que nous avions recensés étant ceux-ci :
– Scientific Opinion for clarification of the meaning of the term « sprayable applications/products » for the nano forms of Carbon Black CI 77266, Titanium Oxide and Zinc Oxide, SCCS, septembre 2014 (publication juin 2015)
– Opinion on Titanium Dioxide (nano form) coated with Cetyl Phosphate, Manganese Dioxide or Triethoxycaprylylsilane as UV-filter in dermally applied cosmetic , SCCS, mars 2017 : (given the) « general lack of dermal absorption and low general toxicity of nano-forms of titanium dioxide, the SCCS considers that the use of the three TiO2 nanomaterials coated with either cetyl phosphate, manganese dioxide or triethoxycaprylylsilane, can be considered safe for use in cosmetic products intended for application on healthy, intact or sunburnt skin. This, however, does not apply to applications that might lead to exposure of the consumer’s lungs to the TiO2 nanoparticles through the inhalation route (such as powders or sprayable products). »
– Opinion on Titanium Dioxide (nano form) as UV-Filter in sprays, SCCS, janvier 2018 : « the SCCS has concluded that the information provided is insufficient to allow assessment of the safety of the use of nano-TiO2 in spray applications that could lead to exposure of the consumer’s lungs. (…) there are already sprayable products on the market containing nano forms of TiO2. Such uses need to be carefully evaluated so that the chance of harmful effects through consumer’s lung exposure by inhalation is avoided » (Le produit concerné : PARSOL® TX de DSM)
→ La forme nano des particules de dioxyde de titane a été introduite dans l’annexe VI du Règlement Cosmétiques (celle qui concerne les filtres solaires) en juillet 2016 pour une entrée en vigueur dès août 2016, à une concentration maximale de 25 % (sauf pour les applications susceptibles de donner lieu à une exposition des poumons des utilisateurs ; l’utilisation dans un spray est interdite pour éviter l’inhalation du fait des risques associés aux nanoparticules de dioxyde de titane). Cf. Règlement 2016/1143 du 13 juillet 2016, publié au Journal officiel de l’Union Européenne le 14 juillet - 13Cf. Règlement (UE) n° 866/2014 de la Commission européenne modifiant les annexes III, V et VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques, 8 août 2014 ; voir également Un filtre UV micronisé autorisé pour les cosmétiques dans l’UE, Premium Beauty News, septembre 2014
- 14Un avis du SCCS sur le MBBT avait été publié en 2013 et révisé en 2015 : Opinion on 2,2′-Methylene-bis-(6-(2H-benzotriazol-2-yl)-4-(1,1,3,3-tetramethylbutyl)phenol) (nano form), Submission III, SCCS, Mars 2015 (publication juin 2015). Le 28 février 2018, un « draft » de Règlement a été validé lors d’une réunion du Standing Committee on Cosmetic Products. Le Règlement (UE) 2018/885 de la Commission modifiant l’annexe VI du règlement (CE) no 1223/2009 du Parlement européen et du Conseil relatif aux produits cosmétiques a été finalisé le 20 juin 2018 et est entré en vigueur le mois suivant. Il autorise l’utilisation de MBBT sous la forme de nanoparticules comme filtre ultraviolet dans les produits cosmétiques, conformément aux spécifications du CSSC, à une concentration de 10 % m/m, sauf pour les applications susceptibles de donner lieu à une exposition des poumons de l’utilisateur final par inhalation de cette substance.
- 15Cf. Règlement (UE) 2022/2195 de la Commission du 10 novembre 2022 modifiant le règlement (CE) no 1223/2009 du Parlement européen et du Conseil en ce qui concerne l’utilisation des substances «Butylated Hydroxytoluene», «Acid Yellow 3», «Homosalate» et «HAA299» dans les produits cosmétiques et rectifiant ledit règlement en ce qui concerne l’utilisation de «Resorcinol» dans les produits cosmétiques. Il peut être utilisé en tant que nanomatériau si la taille médiane des particules D50 (50 % du nombre en dessous de ce diamètre) est ≥ 50 nm sur la base de la distribution numérique par taille.
Comme les autres nanomatériaux autorisés en cosmétique, il ne pourra pas être utilisé dans des applications pouvant conduire à l’exposition des poumons de l’utilisateur final par inhalation pour éviter de potentiels risques sanitaires - 16Cf. « Crèmes antirides : des filtres UV malvenus », 60 Millions de consommateurs, 25 octobre 2018
- 17(82 sur 84)
- 18(RM09 et RM11, pour lesquels les données de génotoxicité fournies n’indiquent aucun problème de génotoxicité)
- 19Au 11 juillet 2013, date de l’entrée en vigueur de la réglementation, le CSSC n’avait pas rendu tous ses avis sur les principaux nano-ingrédients utilisés en cosmétique en réponse à l’industrie cosmétique qui souhaitait leur insertion dans les annexes du Règlement Cosmétiques pour pouvoir les utiliser sans déclaration préalable.
Mais il a ensuite rattrapé son retard. Cf. ci-dessous. - 20Cf. article 16 du règlement (CE) n°1226/2009
- 21En octobre 2013, la Commission européenne, inquiète suite aux 172 notifications de produits contenant des nano-silices, avait pris l’initiative de demander au CSSC un avis sur les nanosilices : Request for a scientific opinion on Silica (nano) CAS n.l 12945-52-5; Hydrated Silica(nano) CAS n. 112926-00-8; Silica Sylilate CAS n. 68909-20-6; Silica Dimethyl silylate (nano) CAS n. 68611-44-9, 2 octobre 2013. Le CSSC a lancé un appel à information entre février et mai 2014 : Call for Information on the safety of Silica (nano) : Silica (nano) CAS n. 112945-52-5; Hydrated Silica(nano) CAS n. 112926-00-8; Silica Sylilate (nano) CAS n. 68909-20-6; Silica Dimethyl Silylate (nano) CAS n. 68611-44-9, février 2014. Puis il a adopté un avis en mars 2015 : Opinion on Silica, Hydrated Silica, and Silica Surface Modified with Alkyl Silylates (nano form), SCCS, mars 2015. Selon le CSSC, les données fournies par les entreprises et la littérature scientifiques étaient alors inadéquates et insuffisantes pour tirer une conclusion sur l’innocuité ou la dangerosité des nano-silices.
A la suite de cette publication, le CSSC a reçu de nombreux commentaires de la part de parties prenantes. En septembre 2015, la Commission a fait savoir que le CSSC allait décider à l’automne s’il allait ou non, en fonction de ces commentaires, produire un avis révisé sur les nano-silices et que la Commission réfléchirait ensuite aux mesures appropriées à déployer afin d’assurer une utilisation sûre des nano-silices dans les produits cosmétiques (cf. Réponse de la commissaire Elzbieta Bienkowska au courrier de juillet 2015 de deux députés européens du groupe Les Verts/Alliance libre européenne, Michèle Rivasi et Bas Eickhout, 3 septembre 2015 - 22Cf. Scientific advice on the safety of nanomaterials in cosmetics, SCCS, 2021 (annex IV)
- 23Cf. Opinion on Gold (nano), Colloidal Gold (nano), Gold Thioethylamino Hyaluronic Acid (nano) and Acetyl heptapeptide-9 Colloidal gold (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), juin 2021 ; cet avis, attendu initialement pour avril 2020, a été rédigé suite à la demande de la Commission européenne formulée fin 2019 ; le SCCS y souligne que la littérature scientifique suggère une possible absorption systémique des nanoparticules d’or (ce qui peut conduire à une accumulation dans certains organes – notamment le foie et la rate) et des effets mutagènes/génotoxiques potentiels des nanomatériaux d’or. Le SCCS conclut qu’il y a lieu de s’inquiéter du fait que l’utilisation de matériaux en or (nano), en or colloïdal (nano) et en or modifié en surface (nano) dans les produits cosmétiques puisse présenter un risque pour la santé humaine > l’interdiction est attendue pour 2022
- 24Voir :
– Opinion on Hydroxyapatite (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), mars 2021
– Opinion on Hydroxyapatite (nano), Scientific Committee on Consumer Safety (SCCS), mars 2016 - 25Cf. Opinion on HAP (hydroxyapatite) nano, Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), mars 2023
- 26Voir notamment :
– Opinion Colloidal Silver (nano), SCCS, octobre 2018
– Call for data on ingredients of Colloidial silver nano in the framework of Regulation 1223/2009 on Cosmetic products, SCCS, mars 2015
– Request for a scientific opinion: Colloidal Silver (nano) CAS No 7440-22-4, EC No 231-131-3, SCCS, date ?
– Minutes of the 5th Plenary Meeting of the Scientific Committee on Consumer Safety (SCCS), 24-25 octobre 2017 : « A request for information and clarification was sent back to Applicants with a deadline by 30 September 2017. Four replies from 3 Applicants have been received and are under assessment. » - 27Cf. Preliminary Opinion on Styrene/Acrylates copolymer (nano) and Sodium styrene/Acrylates copolymer (nano), Sccs, février 2018 (soumise à consultation jusqu’au 11 mai 2018) : « The SCCS cannot conclude on the safety of any of the three styrene/acrylate copolymer nano-entities submitted by the Applicants. The data submitted are insufficient to evaluate possible toxicity. Regarding use it was reported that the nano-entities as present in Nanospheres 100 Theophyllisilane C (SA), were used for encapsulation of a slimming agent Theophyllisilane C. According to the information provided by the Applicants, the formulation might be used in health products like milks, emulsions, creams, lotions and solutions » > l’interdiction est attendue pour 2022
- 28Cf. [[https://ec.europa.eu/health/sites/default/files/scientific_committees/consumer_safety/docs/sccs_o_245.pdf Opinion on Copper (nano) and Colloidal Copper (nano)]], Sccs, 5 mars 2021 > l’interdiction est attendue pour 2022
- 29Preliminary Opinion on Platinum (nano), Colloidal Platinum (nano) and Acetyl tetrapeptide-17 Colloidal Platinum (nano), Sccs, 24-25 juin 2021 > l’interdiction est attendue pour 2022
- 30Cf. Opinion on Fullerenes, Hydroxylated Fullerenes and hydrated forms of Hydroxylated Fullerenes (nano), Comité scientifique pour la sécurité des consommateurs (CSSC / SCCS), novembre 2023
- 31Voir notamment :
– Contrôle de la présence de nanoparticules dans les produits alimentaires et les cosmétiques par la DGCCRF, DGCCRF, janvier 2018
– Nanomatériaux dans les produits cosmétiques : la DGCCRF fait le point, DGCCRF, 22 février 2021
– Composition des cosmétiques : l’exigence d’une information claire des consommateurs, DGCCRF, 15 octobre 2019 - 32– Cf. Bilan des inspections des produits cosmétiques à l’ANSM, ANSM, Congrès Parfums & Cosmétiques, 4 novembre 2020 : l’ANSM a présenté les résultats de tests qu’elle a fait mener en 2019 sur 12 dentifrices de marques différentes, complétant les analyses menées par la DGCCRF sur 5 autres dentifrices. Malheureusement, ces résultats n’ont pas été rendus publics en dehors des congrès réservés aux marques cosmétiques et l’ANSM n’a jamais répondu aux demandes de précisions d’AVICENN.
- 33



